El hierro y el acero son dos elementos fundamentales en nuestra vida cotidiana. Estos materiales son utilizados en una amplia variedad de aplicaciones, desde la construcción de edificios y puentes hasta la fabricación de vehículos y electrodomésticos. En este artículo, exploraremos el fascinante mundo de la producción de hierro y acero, descubriendo el proceso de extracción, fundición y transformación que permite obtener estos materiales tan preciosos. ¡Prepárate para adentrarte en una industria vital para el desarrollo de nuestra sociedad!
Los metales y las aleaciones tienen muchas propiedades útiles en ingeniería y, por lo tanto, se utilizan ampliamente en diseños de ingeniería. El hierro y sus aleaciones (principalmente acero) representan alrededor del 90% de la producción mundial de metales, en gran parte debido a su combinación de buena resistencia, tenacidad y ductilidad a un costo relativamente bajo. Cada metal tiene propiedades especiales para construcciones técnicas y se utiliza tras un análisis de costes comparativo con otros metales y materiales. Veamos la producción de hierro y acero.

Las aleaciones a base de hierro se denominan aleaciones ferrosas y las aleaciones a base de otros metales se denominan aleaciones no ferrosas.
Veamos el procesamiento y producción de hierro y acero.
Producción de arrabio en un alto horno.
La mayor parte del hierro se extrae de los minerales de hierro en grandes altos hornos. A continuación se muestra un ejemplo del esquema de un alto horno.
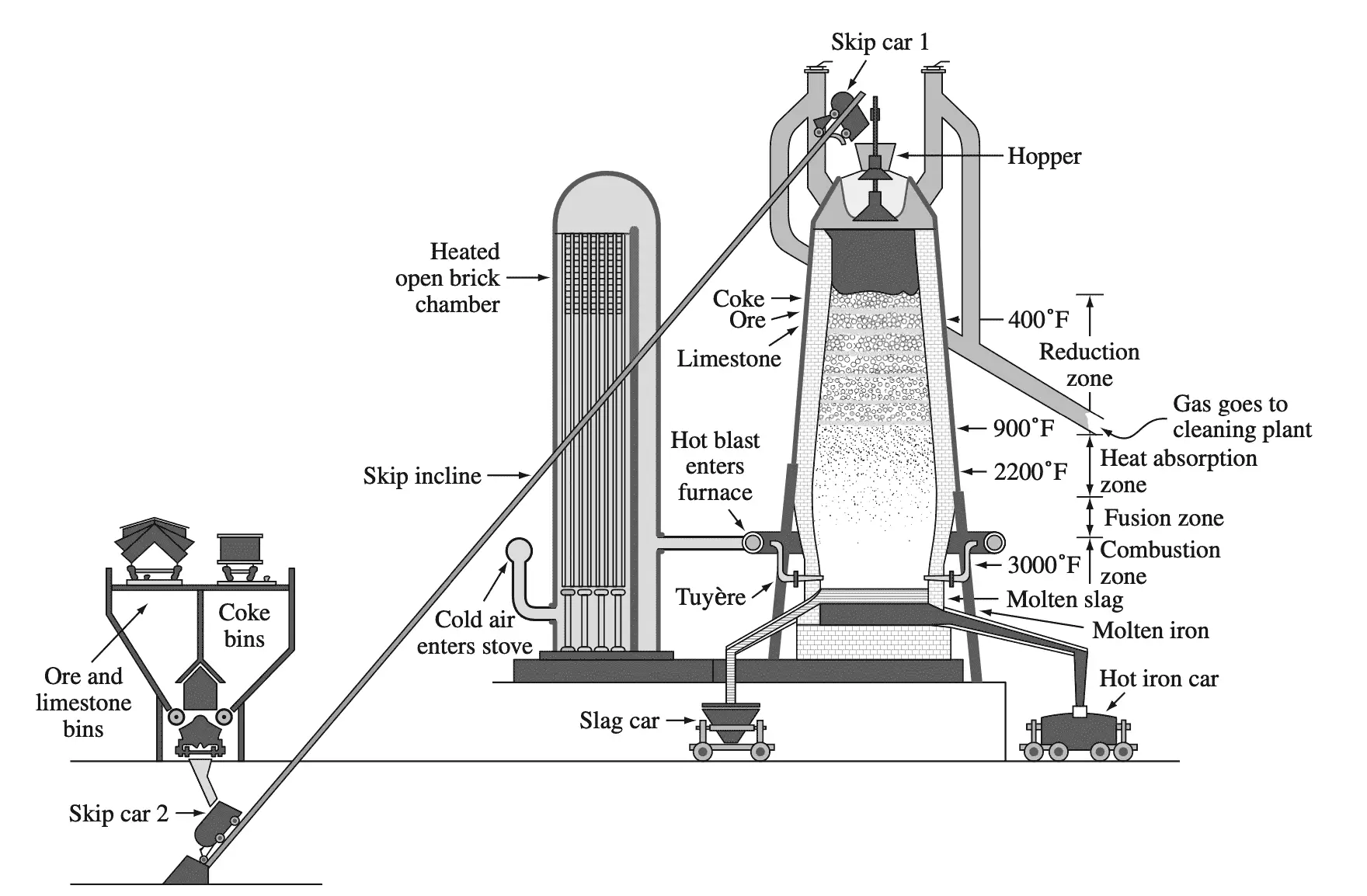
En el alto horno, el coque (carbono) actúa como agente reductor para reducir los óxidos de hierro (principalmente Fe).2oh3) para la producción de arrabio, que según la reacción típica contiene aproximadamente un 4% de carbono, así como algunas otras impurezas
fe2oh3 + 3CO → 2Fe + 3CO2
El arrabio del alto horno normalmente se transfiere a un horno de acero en estado líquido.
Producción de acero y procesamiento de las principales formas de productos de acero.
Por favor habilite JavaScript
Los aceros al carbono son esencialmente aleaciones de hierro y carbono con hasta aproximadamente un 1,2% de carbono. Sin embargo, la mayoría del acero contiene menos del 0,5% de carbono. La mayoría de los aceros se fabrican oxidando el carbono y otras impurezas del arrabio hasta que el contenido de carbono del hierro se reduce al nivel requerido.
El proceso más utilizado para convertir arrabio en acero es el proceso a base de oxígeno. En este proceso, se coloca arrabio y hasta aproximadamente un 30% de chatarra de acero en un convertidor con forma de barril y revestido de material refractario en el que se inserta una lanza de oxígeno, como se muestra en la siguiente figura.
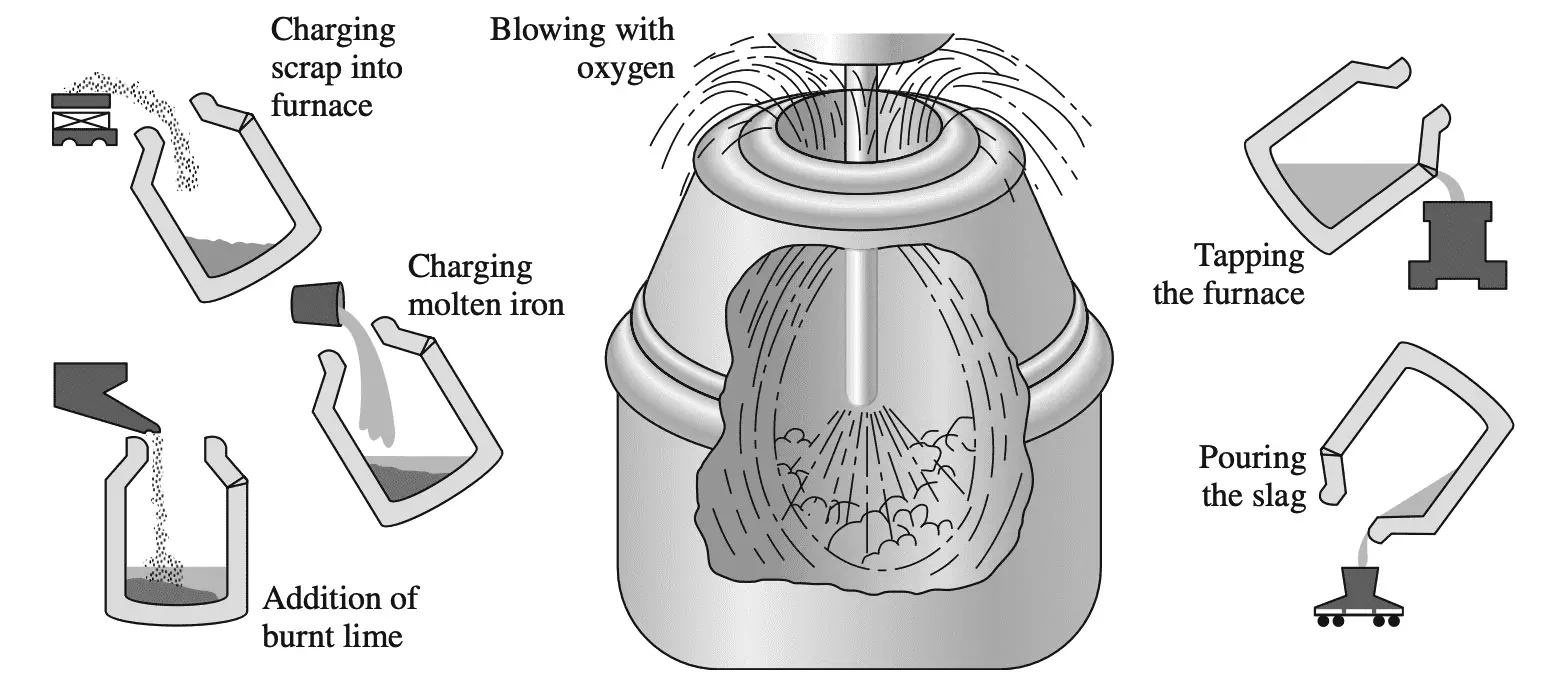
El oxígeno puro de la lanza reacciona con el baño líquido para formar óxido de hierro. Luego, el carbono del acero reacciona con el óxido de hierro para formar monóxido de carbono:
FeO + C → Fe + CO
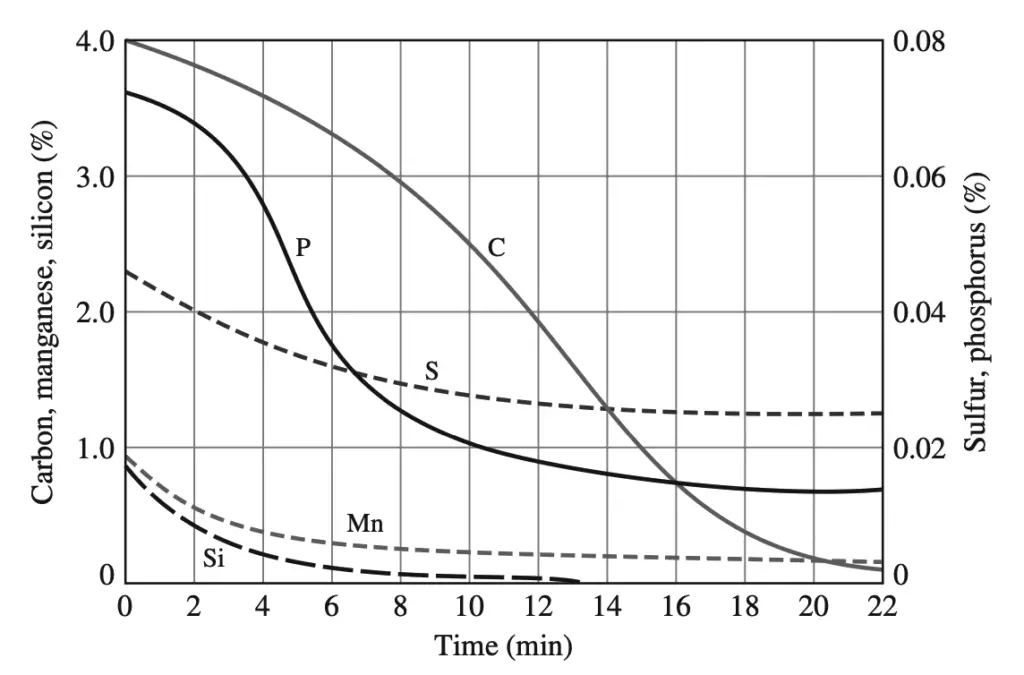
Inmediatamente antes de que comience la reacción del oxígeno, se añaden fundentes formadores de escoria (principalmente cal) en cantidades controladas. Este proceso puede reducir drásticamente el contenido de carbono del acero en unos 22 minutos, al tiempo que reduce la concentración de impurezas como azufre y fósforo.
El acero fundido del convertidor se cuela en moldes estacionarios o de forma continua en placas largas de las que se cortan secciones largas a intervalos regulares.
Hoy en día, aproximadamente el 96 % del acero se fabrica de forma continua, y todavía se fabrican aproximadamente 4.000 lingotes individualmente. Sin embargo, alrededor de la mitad del acero bruto se obtiene reciclando acero viejo, por ejemplo de coches desguazados y electrodomésticos viejos.
Después de la fundición, los lingotes se calientan en una cámara de congelación y se laminan en caliente para obtener desbastes, palanquillas o lingotes. Luego, las losas se laminan en frío y en caliente para formar láminas y placas de acero. Los tochos se laminan en frío y en caliente para formar barras, varillas y alambres, mientras que los trozos se laminan en frío y en caliente para darles formas como vigas en I.
y rieles.
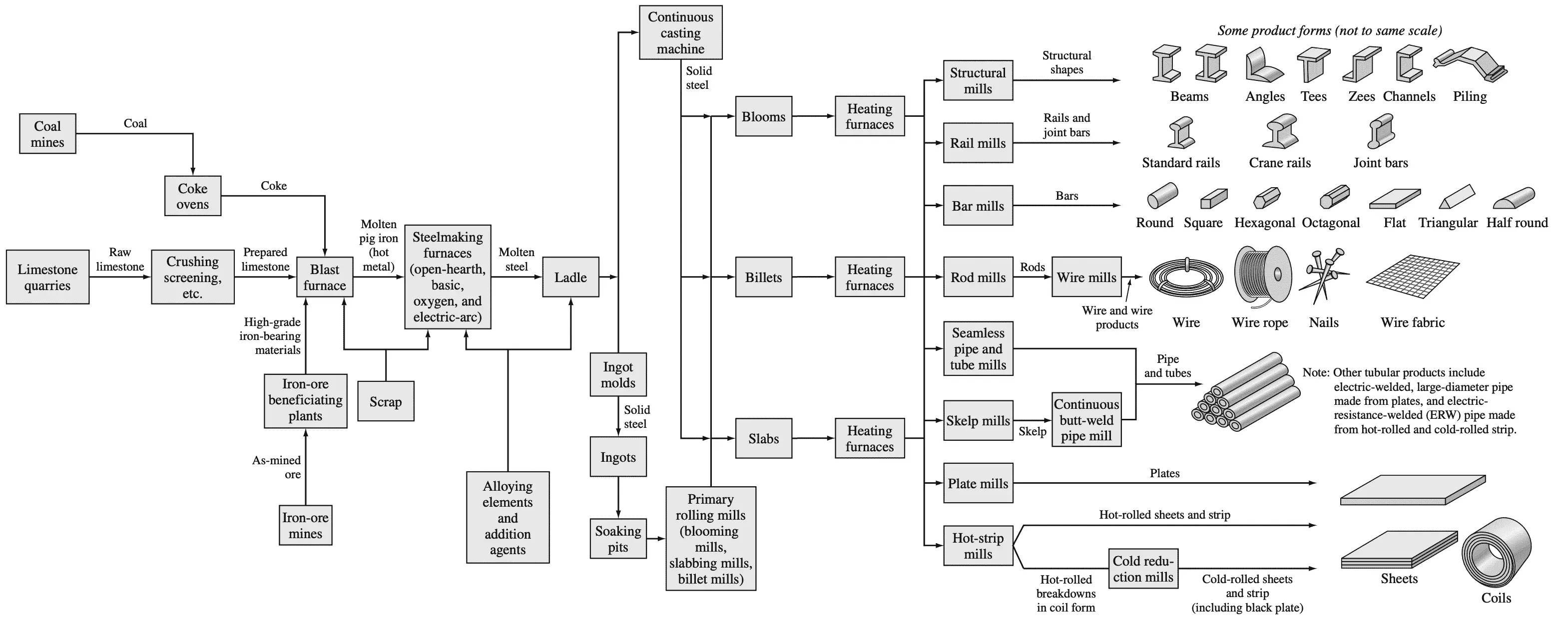
A continuación se muestra un diagrama de flujo que resume los pasos clave del proceso para convertir materias primas en formas clave de productos de acero.
Abrir imagen en vista completa
El sistema hierro-carbono
Las aleaciones de hierro y carbono que contienen una cantidad muy pequeña (aproximadamente 0,03%) a aproximadamente 1,2% de carbono, 0,25 a 1,00% de manganeso y pequeñas cantidades de otros elementos se denominan aceros al carbono puro. Sin embargo, a los efectos de esta sección del libro, los aceros al carbono puro se tratan esencialmente como aleaciones binarias hierro-carbono. Los efectos de otros elementos del acero se analizarán en secciones posteriores.
Carburo de hierro-hierro (Fe – Fe3C) diagrama de fases
Las fases presentes en aleaciones hierro-carbono enfriadas muy lentamente a diversas temperaturas y composiciones de hierro con hasta un 6,67% de carbono se muestran en Fe-Fe.3El diagrama de fase C se muestra a continuación.
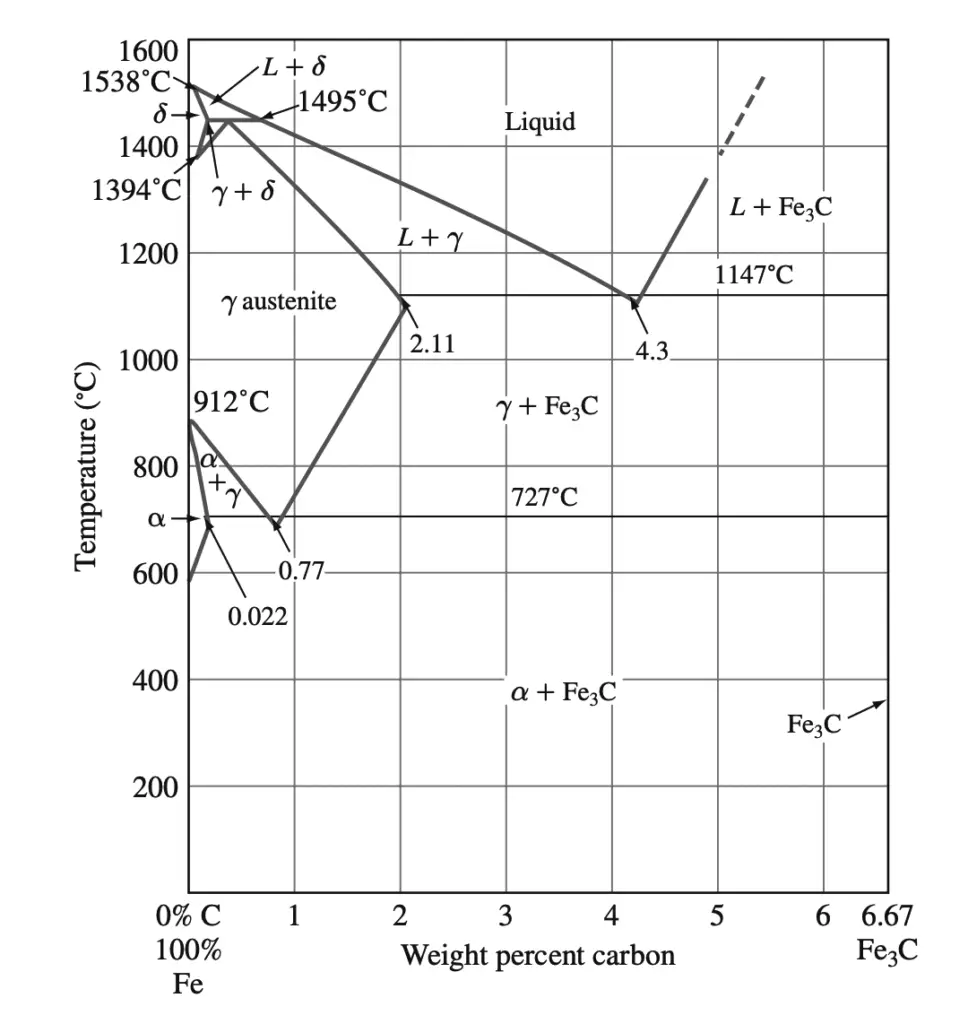
Este diagrama de fases no es un verdadero diagrama de equilibrio porque el compuesto de carburo de hierro (Fe3C) no es una verdadera fase de equilibrio. Bajo ciertas condiciones Fe3El C, llamado cementita, puede descomponerse en las fases más estables de hierro y carbono (grafito). Sin embargo, para la mayoría de las condiciones prácticas, se aplica Fe3C es muy estable y por lo tanto se trata como una fase de equilibrio.
Fases sólidas en Fe-Fe3diagrama de fase C
El Fe-Fe anterior3El diagrama de fases C contiene las siguientes fases fijas:
- ferrita α,
- austenita (γ),
- Cementita (Fe3C)
- δ ferrita
1. α-Ferrita: Esta fase es una solución sólida intersticial de carbono en la red cristalina de hierro BCC. Como lo indica el Fe-Fe3Diagrama de fase C: el carbono es sólo ligeramente soluble en α-ferrita y alcanza una solubilidad sólida máxima del 0,022% a 727 °C. La solubilidad del carbono en la ferrita α disminuye al 0,005% a 0 °C.
2. Austenita (γ): La solución sólida intersticial de carbono en hierro γ se llama austenita. La austenita tiene una estructura cristalina FCC y una solubilidad sólida del carbono mucho mayor que la ferrita α. La solubilidad sólida del carbono en austenita es como máximo del 2,11% a 1148 °C y cae al 0,77% a 727 °C.
3. Cementita (Fe3C): El compuesto intermetálico Fe3C se llama cementita. La cementita tiene límites de solubilidad insignificantes y una composición de 6,67% C y 93,3% Fe. La cementita es un compuesto duro y quebradizo.
4. δ-Ferrita: La solución sólida intersticial de carbono en δ-hierro se llama δ-ferrita. Tiene una estructura cristalina BCC como la α-ferrita pero con una constante de red mayor. La máxima solubilidad sólida del carbono en δ-ferrita es del 0,09% a 1465 °C.
Reacciones invariantes en Fe-Fe3diagrama de fase C
Reacción peritectica
En el punto de reacción peritéctica, un líquido que contiene 0,53% C se combina con δ-ferrita que contiene 0,09% C para formar γ-austenita que contiene 0,17% C. Esta reacción, que ocurre a 1495 °C, se puede escribir de la siguiente manera:
Líquido (0,53% C) + δ(0,09% C) → γ (0,17% C) ….. @1495°C
La ferrita δ es una fase de alta temperatura y, por lo tanto, no se encuentra en aceros al carbono puro a temperaturas más bajas.
Reacción eutéctica
En el punto de reacción eutéctica, se forma un líquido que contiene 4,3% de γ-austenita con 2,11% de C y el compuesto intermetálico Fe.3C (cementita), que contiene 6,67% C.
Esta reacción, que ocurre a 1148 °C, se puede escribir como:
Líquido (4,3% C) → γ-austenita (2,11% C) + Fe3C (6,67% C) …… a 1148 °C
Esta reacción no ocurre con los aceros al carbono puro porque su contenido de carbono es demasiado bajo.
Reacción eutectoide
En el punto de reacción eutectoide, la austenita sólida con 0,77% de C produce α-ferrita con 0,022% de C y Fe.3C (cementita), que contiene 6,67% C. Esta reacción, que ocurre a 727 °C, se puede escribir como
γ-austenita (0,77% C) → α-ferrita (0,022% C) + Fe3C (6,67 % C) ….. a 727 °C
Esta reacción eutectoide, que ocurre completamente en estado sólido, es importante para algunos tratamientos térmicos de aceros al carbono.
El acero al carbono puro que contiene 0,77% de C se denomina acero eutectoide porque tiene una estructura eutectoide de α-ferrita y Fe.3C se forma cuando la austenita de esta composición se enfría lentamente por debajo de la temperatura eutectoide. Si el acero al carbono puro contiene menos del 0,77% de C, se llama acero hipereutectoide. Si el acero contiene más del 0,77% de C, se llama acero hipereutectoide.
[automatic_youtube_gallery type=»search» search=»Producción de hierro y acero.
» limit=»1″]
Producción de Hierro y Acero: Propiedades y Procesos
Los metales y aleaciones tienen muchas propiedades útiles para el diseño de ingeniería y tienen una amplia aplicación en diseños de ingeniería. El hierro y sus aleaciones (principalmente acero) representan aproximadamente el 90% de la producción mundial de metales, principalmente debido a su combinación de buena resistencia, tenacidad y ductilidad a un costo relativamente bajo. Cada metal tiene propiedades especiales para diseños de ingeniería y se utiliza después de un análisis comparativo de costos con otros metales y materiales. Veamos la producción de hierro y acero.
Producción de Pig Iron en un Alto Horno
La mayoría del hierro se extrae de los minerales de hierro en grandes altos hornos. A continuación se muestra un ejemplo del esquema de un alto horno:
En el alto horno, el coque (carbono) actúa como agente reductor para reducir los óxidos de hierro (principalmente Fe2O3) y producir pig iron crudo, que contiene aproximadamente un 4% de carbono junto con algunas otras impurezas según la reacción típica:
Fe2O3 + 3CO → 2Fe + 3CO2
El pig iron del alto horno generalmente se transfiere en estado líquido a un horno siderúrgico.
Siderurgia y Procesamiento de las Principales Formas de Productos de Acero
En la fabricación de aceros al carbono puro, esencialmente se trata de aleaciones de hierro y carbono con hasta aproximadamente un 1.2% de carbono. Sin embargo, la mayoría de los aceros contienen menos del 0.5% de carbono. La mayoría de los aceros se fabrican oxidando el carbono y otras impurezas en el pig iron hasta que el contenido de carbono del hierro se reduce al nivel requerido.
El proceso más comúnmente utilizado para convertir el pig iron en acero es el proceso básico de oxígeno. En este proceso, se carga pig iron y hasta aproximadamente un 30% de chatarra de acero en un convertidor con forma de barril revestido de refractario, en el cual se inserta una lanza de oxígeno:
El oxígeno puro de la lanza reacciona con el baño líquido para formar óxido de hierro. El carbono en el acero luego reacciona con el óxido de hierro para formar monóxido de carbono:
FeO + C → Fe + CO
Inmediatamente antes de que comience la reacción del oxígeno, se agregan en cantidades controladas fundentes formadores de escoria (principalmente cal). En este proceso, el contenido de carbono del acero puede reducirse drásticamente en aproximadamente 22 minutos, junto con una reducción en la concentración de impurezas como azufre y fósforo.
El acero fundido del convertidor se moldea en moldes estacionarios o se moldea continuamente en lingotes largos, de los cuales se cortan periódicamente secciones largas.
Hoy en día, aproximadamente el 96% del acero se moldea continuamente, con aproximadamente 4000 lingotes aún moldeándose individualmente. Sin embargo, aproximadamente la mitad del acero crudo se produce reciclando acero viejo, como automóviles y electrodomésticos.
Después de moldearse, los lingotes se calientan en un horno y se laminan en caliente para formar placas, billets o bloques. Las placas se laminan posteriormente en caliente y en frío para formar láminas y placas de acero. Los billets se laminan en caliente y en frío para formar barras, varillas y alambres, mientras que los bloques se laminan en caliente y en frío para formar estructuras como vigas en I y rieles.
A continuación se muestra un diagrama de flujo que resume los pasos principales del proceso involucrado en la conversión de las materias primas en las formas principales de productos de acero.
El Sistema Hierro-Carbono
Las aleaciones hierro-carbono que contienen desde una cantidad muy pequeña (aproximadamente 0.03%) hasta aproximadamente un 1.2% de carbono, 0.25 a 1.00% de manganeso y pequeñas cantidades de otros elementos se denominan aceros al carbono puro. Sin embargo, para fines de esta sección, los aceros al carbono puro serán tratados como aleaciones binarias hierro-carbono. Los efectos de otros elementos en el acero se tratarán en secciones posteriores.
Diagrama de Fase Hierro-Hierro-Carburo (Fe-Fe3C)
Las fases presentes en aleaciones hierro-carbono enfriadas muy lentamente a diversas temperaturas y composiciones de hierro con hasta un 6.67% de carbono se muestran en el diagrama de fase Fe-Fe3C a continuación:
Este diagrama de fase no es un diagrama de equilibrio verdadero, ya que el compuesto carburo de hierro (Fe3C) que se forma no es una fase de equilibrio verdadera. En ciertas condiciones, el Fe3C, llamado cementita, puede descomponerse en las fases más estables de hierro y carbono (grafito). Sin embargo, para la mayoría de las condiciones prácticas, el Fe3C es muy estable y, por lo tanto, se tratará como una fase de equilibrio.
Fases sólidas en el diagrama de fase Fe-Fe3C:
- α ferrita: Esta fase es una solución sólida intersticial de carbono en la red cristalina de hierro BCC. Como se indica en el diagrama de fase Fe-Fe3C, el carbono es solo ligeramente soluble en α ferrita, alcanzando una solubilidad sólida máxima de 0.022% a 727°C. La solubilidad de carbono en α ferrita disminuye a 0.005% a 0°C.
- Austenita (γ): La solución sólida intersticial de carbono en hierro γ se llama austenita. La austenita tiene una estructura cristalina FCC y una solubilidad sólida mucho mayor para el carbono que α ferrita. La solubilidad sólida de carbono en austenita es un máximo de 2.11% a 1148°C y disminuye a 0.77% a 727°C.
- Cementita (Fe3C): El compuesto intermetálico Fe3C se llama cementita. La cementita tiene límites de solubilidad despreciables y una composición de 6.67% de carbono y 93.3% de hierro. La cementita es un compuesto duro y quebradizo.
- δ ferrita: La solución sólida intersticial de carbono en hierro δ se llama δ ferrita. Tiene una estructura cristalina BCC al igual que α ferrita, pero con una constante de red mayor. La solubilidad sólida máxima de carbono en δ ferrita es 0.09% a 1465°C.
Reacciones Invariantes en el Diagrama de Fase Fe-Fe3C
Reacción Peritéctica:
En el punto de reacción peritéctica, un líquido de 0.53% de C se combina con δ ferrita de 0.09% de C para formar γ austenita de 0.17% de C. Esta reacción, que ocurre a 1495°C, se puede escribir como:
Líquido (0.53% de C) + δ (0.09% de C) → γ (0.17% de C) … @ 1495°C
La δ ferrita es una fase de alta temperatura y, por lo tanto, no se encuentra en aceros al carbono puro a temperaturas más bajas.
Reacción Eutéctica:
En el punto de reacción eutéctica, un líquido del 4.3% forma γ austenita del 2.11% de C y el compuesto intermetálico Fe3C (cementita), que contiene 6.67% de C.
Esta reacción, que ocurre a 1148°C, se puede escribir como:
Líquido (4.3% de C) → γ austenita (2.11% de C) + Fe3C (6.67% de C) … @ 1148°C
Esta reacción no se encuentra en aceros al carbono puro porque su contenido de carbono es demasiado bajo.
Reacción Eutectoide:
En el punto de reacción eutectoide, la austenita sólida del 0.77% de C produce α ferrita con un 0.022% de C y Fe3C (cementita) que contiene 6.67% de C.
Esta reacción, que ocurre a 727°C, se puede escribir como:
γ austenita (0.77% de C) → α ferrita (0.022% de C) + Fe3C (6.67% de C) … @ 727°C
Este tipo de reacción eutectoide, que se lleva a cabo completamente en el estado sólido, es importante para algunos tratamientos térmicos de aceros al carbono puro.
El acero al carbono puro que contiene 0.77% de C se denomina acero eutectoide, ya que se forma una estructura eutectoide de α ferrita y Fe3C cuando la austenita de esta composición se enfría lentamente por debajo de la temperatura eutectoide. Si el acero al carbono puro contiene menos del 0.77% de C, se denomina acero hipereutectoide, y si el acero contiene más del 0.77% C, se denomina acero hiper eutectoide.
Preguntas Frecuentes sobre la Producción de Hierro y Acero:
-
¿Cuál es la principal aplicación del hierro y sus aleaciones en diseños de ingeniería?
El hierro y sus aleaciones, especialmente el acero, se utilizan ampliamente en diseños de ingeniería debido a su combinación de resistencia, tenacidad y ductilidad a un costo relativamente bajo.
-
¿Cuál es el principal proceso de fabricación utilizado para convertir el pig iron en acero?
El proceso más comúnmente utilizado es el proceso básico de oxígeno, donde el pig iron se carga en un convertidor junto con chatarra de acero y se inyecta oxígeno puro para reducir el contenido de carbono y otras impurezas en el acero.
-
¿Cuál es la estructura de fase más estable en el diagrama de fase Fe-Fe3C?
La cementita (Fe3C) se trata como la fase de equilibrio más estable en el diagrama de fase Fe-Fe3C. Aunque en ciertas condiciones puede descomponerse en hierro y carbono como grafite, en la mayoría de las condiciones es muy estable.
Para obtener más información sobre la producción de hierro y acero, puedes visitar los siguientes enlaces:
